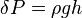Estado
de agregación de la materia

Este diagrama muestra la nomenclatura para las diferentes transiciones
de fase su reversibilidad y
relación con la variación de la entalpía.
En física y química se observa que, para cualquier sustancia o mezcla, modificando sus condiciones de temperatura o presión, pueden obtenerse distintos estados o
fases, denominados estados de agregación de la materia, en relación con
las fuerzas de unión de
las partículas (moléculas, átomos o iones) que la constituyen.
Estado sólido
Los objetos en estado sólido se presentan como cuerpos de forma
definida; sus átomos a menudo se entrelazan formando estructuras estrechas
definidas, lo que les confiere la capacidad de soportar fuerzas sin deformación
aparente. Son calificados generalmente como duros y resistentes, y en ellos las
fuerzas de atracción son mayores que las de repulsión. En los sólidos cristalinos, la presencia de espacios
intermoleculares pequeños da paso a la intervención de las fuerzas de enlace, que ubican a las celdillas en formas geométricas. En los amorfos o vítreos, por el contrario, las
partículas que los constituyen carecen de una estructura ordenada.
Las sustancias en estado sólido suelen presentar algunas de las
siguientes características:
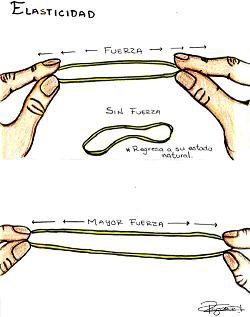
- Cohesión elevada;
- Tienen una forma definida y memoria de forma, presentando fuerzas
elásticas restitutivas si se deforman fuera de su configuración original;
- A efectos prácticos son incompresibles,
- Resistencia a la fragmentación;
- Fluidez muy baja o nula;
- Algunos de ellos se subliman.
Estado líquido
Si se incrementa la temperatura de un sólido, este va perdiendo forma hasta desaparecer la estructura cristalina,
alcanzando el estado líquido. Característica principal: la capacidad de fluir y
adaptarse a la forma del recipiente que lo contiene. En este caso, aún existe
cierta unión entre los átomos del cuerpo, aunque mucho menos intensa que en los
sólidos. El estado líquido presenta las siguientes características:
- Cohesión menor.
- Movimiento energía cinética.
- Son fluidos, no poseen forma definida, ni memoria de forma por lo
que toman la forma de la superficie o el recipiente que lo contiene.
- En el frío se contrae (exceptuando el agua).
- Posee fluidez a través de pequeños orificios.
- Puede presentar difusión.
- Son poco compresibles.
Estado gaseoso
Se denomina gas al estado de agregación de la materia que no tiene forma
ni volumen definido. Su principal composición son moléculas no unidas,
expandidas y con poca fuerza de atracción, haciendo que no tengan volumen y
forma definida, provocando que este se expanda para ocupar todo el volumen del
recipiente que la contiene, con respecto a los gases las fuerzas gravitatorias
y de atracción entre partículas resultan insignificantes. Es considerado en
algunos diccionarios como sinónimo de vapor, aunque no hay que confundir sus
conceptos, ya que el término de vapor se refiere estrictamente para aquel gas
que se puede condensar por presurización a temperatura constante. Los gases se
expanden libremente hasta llenar el recipiente que los contiene, y su densidad
es mucho menor que la de los líquidos y sólidos.
Dependiendo de sus contenidos de energía o de las fuerzas que actúan, la
materia puede estar en un estado o en otro diferente: se ha hablado durante la
historia, de un gas ideal o de un sólido cristalino perfecto, pero ambos son
modelos límites ideales y, por tanto, no tienen existencia real.
En los gases reales no existe un desorden total y absoluto, aunque sí un
desorden más o menos grande.
En un gas, las moléculas están en estado de caos y muestran poca
respuesta a la gravedad. Se mueven tan rápidamente que se liberan unas de
otras. Ocupan entonces un volumen mucho mayor que en los otros estados porque
dejan espacios libres intermedios y están enormemente separadas unas de otras.
Por eso es tan fácil comprimir un gas, lo que significa, en este caso,
disminuir la distancia entre moléculas. El gas carece de forma y de volumen,
porque se comprende que donde tenga espacio libre allí irán sus moléculas
errantes y el gas se expandirá hasta llenar por completo cualquier recipiente.
El estado gaseoso presenta las siguientes características:
- Cohesión casi nula.
- No tienen forma definida.
- Su volumen es variable.
Estado plasmático
El plasma es un gas ionizado, es decir que los átomos que lo componen se
han separado de algunos de sus electrones. De esta forma el plasma es un estado
parecido al gas pero compuesto por aniones y cationes (iones
con carga negativa y positiva, respectivamente), separados entre sí y libres,
por eso es un excelente conductor. Un ejemplo muy claro es el Sol.
En la baja Atmósfera terrestre,
cualquier átomo que pierde un electrón (cuando es alcanzado por una partícula
cósmica rápida) se dice que está ionizado. Pero a altas temperaturas es muy
diferente. Cuanto más caliente está el gas, más rápido se mueven sus moléculas y átomos, (ley de los gases
ideales) y a muy altas temperaturas las colisiones entre estos
átomos, moviéndose muy rápido, son suficientemente violentas para liberar los
electrones. En la atmósfera solar, una gran parte de los átomos están
permanentemente «ionizados» por estas colisiones y el gas se comporta como un
plasma.
A diferencia de los gases fríos (por ejemplo, el aire a temperatura
ambiente), los plasmas conducen la electricidad y son fuertemente influidos por los campos magnéticos.
La lámpara fluorescente,
contiene plasma (su componente principal es vapor de mercurio) que calienta y
agita la electricidad, mediante la línea de fuerza a la que está conectada la
lámpara. La línea, positivo eléctricamente un extremo y negativo, causa que los
iones positivos se aceleren hacia el extremo negativo, y que los electrones
negativos vayan hacia el extremo positivo. Las partículas aceleradas ganan
energía, colisionan con los átomos, expulsan electrones adicionales y mantienen
el plasma, aunque se recombinen partículas. Las colisiones también hacen que
los átomos emitan luz y esta forma de luz es más eficiente que las lámparas
tradicionales. Los letreros de neón y las luces urbanas funcionan por un
principio similar y también se usaron en electrónicas.
Cambios de estado
 Para cada elemento o compuesto químico
existen determinadas condiciones de presión y temperatura a las que se producen
los cambios de estado, debiendo interpretarse, cuando se hace referencia
únicamente a la temperatura de cambio de estado, que ésta se refiere a la
presión de la atm. (la presión atmosférica).
De este modo, en "condiciones normales"
(presión atmosférica, 0 °C) hay compuestos tanto en estado sólido como
líquido y gaseoso (S, L y G).
Para cada elemento o compuesto químico
existen determinadas condiciones de presión y temperatura a las que se producen
los cambios de estado, debiendo interpretarse, cuando se hace referencia
únicamente a la temperatura de cambio de estado, que ésta se refiere a la
presión de la atm. (la presión atmosférica).
De este modo, en "condiciones normales"
(presión atmosférica, 0 °C) hay compuestos tanto en estado sólido como
líquido y gaseoso (S, L y G).
 , el peso específico;
, el peso específico;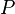 , el peso de la sustancia;
, el peso de la sustancia; , el volumen de la sustancia;
, el volumen de la sustancia; , la densidad de la sustancia;
, la densidad de la sustancia; , la masa de la sustancia;
, la masa de la sustancia; , la aceleración de la gravedad.
, la aceleración de la gravedad.



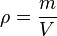
 (convergiendo hacia un volumen muy pequeño) y estén centrados alrededor de un punto, siendo
(convergiendo hacia un volumen muy pequeño) y estén centrados alrededor de un punto, siendo  la masa contenida en cada uno de los volúmenes anteriores, la densidad en el punto común a todos esos volúmenes:
la masa contenida en cada uno de los volúmenes anteriores, la densidad en el punto común a todos esos volúmenes: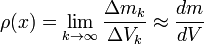

 sobre el émbolo de menor área
sobre el émbolo de menor área 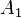 se genera una presión
se genera una presión  :
:
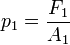
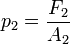

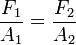 y la relación de fuerzas:
y la relación de fuerzas: 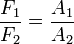

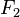 = fuerza del émbolo mayor en N.
= fuerza del émbolo mayor en N.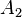 = área del émbolo mayor en m².
= área del émbolo mayor en m².